Preparación de soluciones amortiguadoras
Preparación de soluciones mortiguadoras
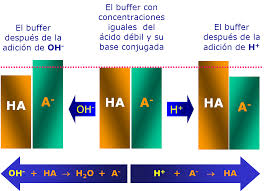
Las soluciones buffer o amortiguadoras resisten los cambios
de pH ya que contienen ácidos-base débiles conjugados que neutralizan los iones
H+ y OH-. Las soluciones amortiguadoras consisten de ácidos o bases débiles y
las sales de esos ácidos o bases. Escoger un sistema amortiguador apropiado
depende de los rangos de pH a amortiguar. La mayoría de as reacciones
biológicas ocurren en un rango de pH que va de 6 a 8. Los buffers de fosfato
amortiguan a un rango de pH de 6,5 a 7,5. Los buffers de ácido carboxílico son
útiles para un pH de 3 a 6. Los buffers de borato funcionan en un pH de 8,5 a
10. Los buffers de aminoácido como la glicina y la histidina pueden usarse en
varios rangos de pH. El buffer Tris es uno de los sistemas amortiguadores más
utilizados en laboratorios biológicos. En el siguiente ejemplo se utilizarán
cálculos para soluciones de buffer Tris, pero la metodología se aplica de igual
forma para cualquier solución amortiguadora.
``La mayoría de los organismos, incluidos los seres humanos, necesitan mantener el pH dentro de un rango muy reducido para poder sobrevivir. Por ejemplo, la sangre humana necesita mantener su pH justo alrededor de 7.4 y evitar variaciones significativas hacia arriba o hacia abajo, aun cuando sustancias ácidas o alcalinas entren o salgan del torrente sanguíneo.
Las soluciones amortiguadoras, capaces de resistir cambios en el pH, son indispensables para mantener estable la concentración de iones hidrógeno H en los sistemas biológicos. Cuando hay demasiados iones H, una solución amortiguadora absorberá parte de ellos, subiendo el pH; y cuando hay muy pocos, la solución amortiguadora aportará algunos de sus propios iones H para reducir el pH. Las soluciones amortiguadoras consisten generalmente de un par ácido-base, cuya diferencia radica en la presencia o ausencia de un protón (un par ácido-base conjugado).
Por ejemplo, una de las soluciones amortiguadoras que mantienen el pH en la sangre humana está formada por el ácido carbónico (HCO) y su base conjugada, el ion bicarbonato (HCO). El ácido carbónico se forma cuando el dióxido de carbono entra al torrente sanguíneo y se combina con el agua, y es la forma principal en la que el dióxido de carbono viaja en la sangre entre los músculos (donde se produce) y los pulmones (donde es liberado como producto de desecho).´´
Si se acumulan demasiados iones H, la ecuación de arriba se moverá hacia la derecha y los iones bicarbonato absorberán los H para formar ácido carbónico. De igual manera, si la concentración de H baja demasiado, la ecuación irá hacia la izquierda y el ácido carbónico se convertirá en bicarbonato, donando iones H a la solución. Sin este sistema amortiguador, las variaciones en el pH del cuerpo humano serían tan grandes que pondrían en riesgo la supervivencia.
Estas soluciones son muy útiles puesto que sirven
para evitar reacciones indeseadas que se llevarían a cabo si hay
variaciones de la acidez de la disolución.
Las Soluciones Amortiguadoras tienen una importancia vital en Bioquímica ya que de la constancia del pH en los organismos depende el correcto funcionamiento a nivel celular. También son importantes a nivel industrial y en el laboratorio.
Las Soluciones Amortiguadoras tienen una importancia vital en Bioquímica ya que de la constancia del pH en los organismos depende el correcto funcionamiento a nivel celular. También son importantes a nivel industrial y en el laboratorio.
Ejemplos de Soluciones Amortiguadoras:
- NH3 (base
débil) y NH4Cl (ácido conjugado)
- CH3COOH (ácido débil)
y CH3COONa (base conjugada)
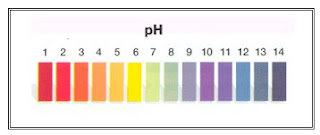
- El pH
de la sangre permanece constante entre un margen de 7,3 y 7,5 (ligeramente
básico) gracias a la acción de soluciones amortiguadoras presentes en las
proteínas del suero sanguíneo. Dichas proteínas están formadas por
aminoácidos que presentan grupos carboxilo ácidos (-COOH) y también
grupos básicos como los aminos (-NH2).
- Mezclas
de iones carbonato (CO32-) e iones bicarbonato (HCO3-)
- Mezclas
de iones fosfato ácido (H2PO4-) e
iones de fosfato básico (HPO42-)
- Mezcla
de ácido fórmico (HCOOH) y formiato de potasio (HCOOK)
- Mezcla
de ácido benzoico (C6H5COOH) y benzoato de potasio (C6H5COONa)
- Mezcla de ácido fosfórico (H3PO4) y fosfato de sodio (Na3PO4)
Preparación de Soluciones Amortiguadoras:
Para preparar una solución amortiguadora se deben tener en
cuenta las siguientes consideraciones:
- En
primer lugar necesitamos conocer el pH al que queremos tener una solución
amortiguadora
- A
continuación buscamos un ácido o una base que se encuentre cerca del pH
buscado
- Se calcula el pH sin solución amortiguadora aplicando la ecuación de Henderson-Hasselbalch:
pH = pKa + log ([S]
/ [A])
- pKa =
- log10 Ka donde Ka es la constante de
acidez
- [S]
es la concentración de la sal formada por su base conjugada
- [A]
es la concentración del ácido
APLICACIONES DE ESTE TIPO DE SOLUCIONES:
Además de que ese tipo de soluciones son útiles para el
mantenimiento del pH en sistemas biológicos, también tienen aplicaciones en la
industria.
Industria agrícola: Se usa para la fertirrigación y la
agricultura hidropónica.
Industria alimentaria: Conocer los parámetros del pH nos
ayuda a saber si los alimentos son aptos para el consumo humano.
Industria farmacéutica: El control del PH es fundamental en
el diseño, formulación y ensayos previos a la comercialización de medicamentos.
En microbiología y en estudios genéticos también se
usan los buffers. Uno de los productos destinados a este fin es el buffer de
carga 6X para DNA
BIBLIOGRAFIAS
- Carla Boulianne . (s.f.). Cómo preparar soluciones amortiguadoras. 25 de octubre 2017, de eHow en español Sitio web: http://www.ehowenespanol.com/preparar-soluciones-amortiguadoras-como_112391/
- khanacademy. (2015). Ácidos, bases, pH y soluciones amortiguadoras. 25 de obtubre, de khanacademy Sitio web: https://es.khanacademy.org/science/biology/water-acids-and-bases/acids-bases-and-ph/a/acids-bases-ph-and-bufffers
- quimicas. (2017). las soluciones amortiguadoras. 25 de octubre, de quimicas Sitio web: http://www.quimicas.net/2015/11/ejemplos-de-soluciones-amortiguadoras.html
- QuimiNet.(2012),"buffers y su importancia en la industria", recuperadode:https://www.quiminet.com/articulos/los-buffers-y-su-importancia-en-la-industria-3006102.htm, 25/octubre/2017.




Comentarios
Publicar un comentario